今天介绍的是烟草蚀纹病毒(Tobacco Etch Virus,TEV),它是少数几个拥有高专一性蛋白酶的病毒。
简介

烟草蚀纹病毒(Tobacco Etch Virus/TEV)是一种隶属于马铃薯Y病毒(Potyvirus)的植物病毒,TEV具有单链正义RNA基因组,被由单一病毒编码蛋白质制成的衣壳包围。病毒是长约730纳米的丝状颗粒。它通过包括桃蚜在内的10多种蚜虫以非持续性的方式传播。它也很容易通过机械手段传播,但目前还不知道通过种子传播。
病毒宿主
该病毒可感染茄科许多种植物。它侵染的重要农业作物包括辣椒(即C. annuum与C. frutescens)、番茄(Lycopersicon esculentum)和烟草(Nicotiana spp.)。
它还感染许多多年生杂草,可作为病毒库易感的农业作物。这些杂草种类包括龙葵(Solanum nigrum)、狗茄子(Solanum aculeatissimum)、藜(Chenopodium album)、曼陀罗(Datura stramonium)、加拿大柳蓝花(Linaria canadensis)和酸浆属(地樱桃)。因此,控制该病毒的建议包括控制敏感茄科作物及其周围的杂草。
症状表现
感染烟草蚀纹病毒的植物的症状可能因植物而异。然而,典型的症状包括无叶脉、斑驳和坏死线或蚀刻。症状可能出现在叶子和果实上,植物可能会发育不良。
以TEV为代表的马铃薯Y病毒家族产生的病毒包涵体如果染色得当,可以在光学显微镜下看到。马铃薯Y病毒产生两种可在已知宿主中诊断的内含物。其中一个包涵体是在感染细胞的细胞质中发现的圆柱形包涵体,第二个包涵体在细胞核中发现。核酸染色(天青A/Azure A)中无包涵型染色。(烟草蚀刻病毒包含在各种宿主中)
地理分布
TEV似乎是一种在***进化的病毒,在加拿大、美国(包括夏威夷)、北美的墨西哥和波多黎各以及南美的委内瑞拉都有报道。
烟草蚀纹病毒(TEV)蛋白酶
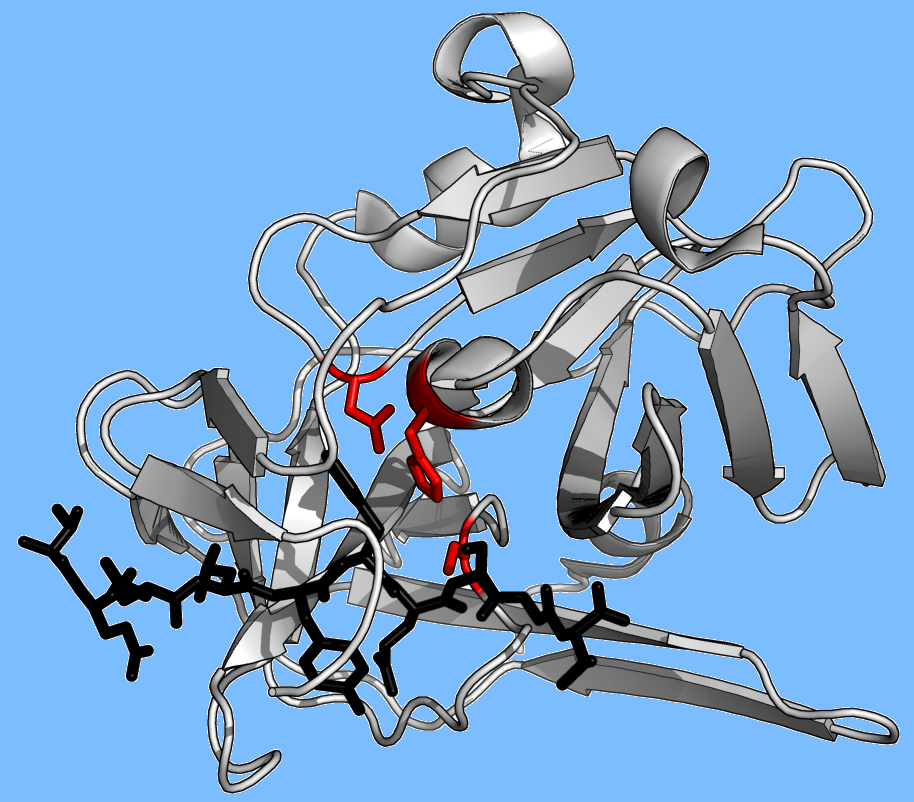
TEV蛋白酶(Tobacco Etch Virus nuclear内含物-a 内肽酶)是从烟草蚀刻病毒(TEV)中提取的一种高度序列特异性的半胱氨酸蛋白酶它是胰凝乳蛋白酶样蛋白酶PA族的一员。由于其高度的序列特异性,常被用于融合蛋白的体外和体内的控制切割。
结构
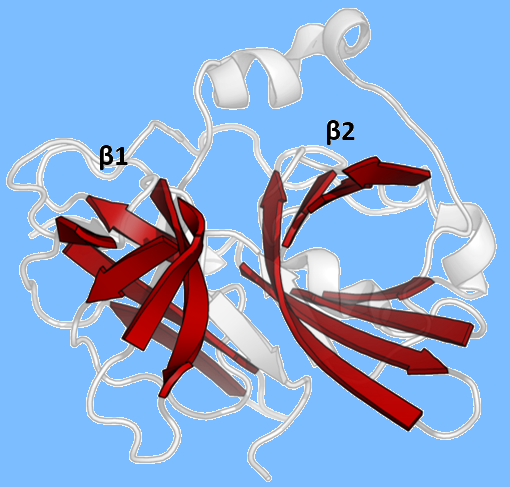
用X射线晶体学方法确定了TEV蛋白酶的结构它由两个β-桶和一条灵活的c端尾组成,与蛋白酶的糜蛋白酶超家族(PA族,MEROPS分类为C4家族)具有结构同源性虽然与细胞丝氨酸蛋白酶(如胰蛋白酶,弹性蛋白酶,凝血酶等)同源,TEV蛋白酶使用半胱氨酸作为其催化亲核试剂(与许多其他病毒蛋白酶一样)。
采用Asp-His-Cys三元共价催化,在两个桶之间分裂(Asp在β1上,His和Cys在β2上)底物为β-薄片,与木桶之间的裂缝形成反平行相互作用,与c端尾部形成平行相互作用因此,酶在底物周围形成一个结合通道,侧链相互作用控制特异性。
专一性
首选的,自然的切割序列首先通过检查切割位点在自然多蛋白底物的重复序列确定。这些本地切割位点的共识是ENLYFQ\S,其中“\”表示分裂的肽键底物残基在切前标记为P6 - P1,切后标记为P1’。早期的工作还测量了一系列类似底物的切割,以表征该蛋白酶对自然序列的特异性。
随后的研究利用从随机序列池中切割底物的测序来确定偏好模式。虽然ENLYFQ\S是最优序列,但该蛋白酶在一定范围的底物上或多或少具有活性(即显示一些底物乱序)。最接近共识EXLYΦQ\φ的序列解理最高,其中X是任何残基,Φ是任何大中型疏水残基,φ是任何小型疏水或极性残基。虽然该序列是最优的,但如果序列的其他部分是最优的,在某些位置残基不利的序列仍然可以被切割。
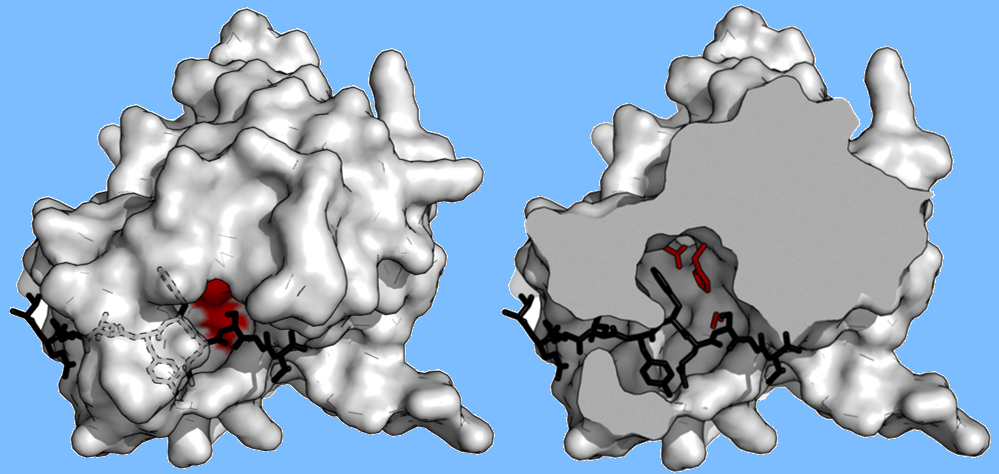
酶与底物接触面积大,具有专一性。蛋白酶,如胰蛋白酶,由于只有一个或两个袋结合底物侧链的浅结合断裂,因此对裂解键前后的一个残基具有特异性。相反,病毒蛋白酶,如TEV蛋白酶,有一个长长的c端尾,它完全覆盖底物,形成一个结合隧道。该通道包含一组紧密结合袋,使得底物肽的每一条侧链(P6到P1′)都结合在一个互补位点(S6到S1′)
特别是肽侧链P6-Glu连接三个氢键网络;P5-Asn指向溶剂,没有特定的相互作用(因此在该位置缺乏底物共识);P4-Leu被埋在疏水口袋中;P3-Tyr被固定在一个末端有短氢键的疏水口袋中;p2 -苯丙氨酸也被疏水分子包围包括三联组氨酸的表面;P1-Gln形成4个氢键;而P1′-Ser仅部分封闭在浅层疏水槽中。
生物技术应用
该蛋白的主要用途之一是从纯化的重组融合蛋白中去除亲和标记。TEV蛋白酶作为生化工具的原因是其较高的序列特异性。当偏好序列插入到柔性环中时,这种特异性允许控制蛋白质的切割。这也使得它在体内相对无毒,因为被识别的序列很少出现在蛋白质中。
尽管定向优化设计在改变蛋白酶特异性方面取得了有限的成功,但定向进化已经被用于改变断裂位点之前或之后的首选残基。
然而,TEV蛋白酶作为生化工具也有局限性。它容易通过自裂(自溶)而失活,尽管这种失活可以通过内部劈裂位点的单个S219V突变来消除单独表达的蛋白酶溶解性也很差,然而,通过定向进化和计算设计,已经进行了几次尝试来改善其溶解性。也有研究表明,麦芽糖结合蛋白(MBP)作为溶解度增强的伙伴,可以通过融合提高表达。
据报道,TEV蛋白酶在4°C时的活性下降了10倍,在34°C以上的温度下失去活性。这种酶的分子量在25 - 27kda之间变化,这取决于所使用的特定结构。
